Pemeriksaan mikroskopik cepat untuk Negri bodies dan persiapan spesimen untuk tes biologis
Virus rabies menyebabkan timbulnya inklusi bodi yang spesifik, yang dikenal dengan Negri bodies, dalam sitoplasma sel syaraf atau sel kultur yang terinfeksi. Inklusi bodies ini ini dapat dideteksi secara histopatologis dengan mikroskop atau dengan flourscent antibodi (FA) test.
 |
| Mikroskop FAT. pemeriksaan FAT diruang gelap (sumber : http://www.who-rabies-bulletin.org/about_rabies/Diagnosis.aspx) |
 |
| Positif Rabies ; Negri Bodies yang berpendar dalam pemeriksaan FAT. (sumber : http://www.who-rabies-bulletin.org/about_rabies/Diagnosis.aspx) |
Teknik pengerjaan dalam laboraatorium diagnosis rabies sebaiknya dilakukan dalam kondisi yang optimum menyangkut kekakuratan, ketepatan, kecepatan, dan ekonomi. Metode pengerjaan pemeriksaan mikroskopis untuk Negri bodies dalam kesempatan ini, menggunakan aplikasi pengerjaan jaringan otak sederhana pada kaca preparat dan pewarnaan Seller.
Diseksi (pemotongan) jaringan otak
Prosedur pemotongan sederhana diperlukan untuk menemukan tanduk ammon (ammon’s horn) yang merupakan area terbaik untuk menemukan negri bodies pada hewan yang terkena rabies.
Dengan gunting steril, lakukan incise longitudinal di area dorsal tiap bagian hemisphere cerebral, yaitu sekitar 2 cm dari fissure longitudinal atau areal midline dari otak.
Insisi dibuat dari region occipital dari hemisphere dan memanjang sekitar 3-5 cm dan menembus ke bawah melalui gray matter, lalu white matter hingga menemui sebuah rongga, yang menadakan wilayah ventrikel lateral dicapai.
 |
| Ilustrasi ammon horn. ammon horn memiliki suatu daerah yang bernama hippokampus, yang merupakan area utama dalam pemeriksaan rabies. |
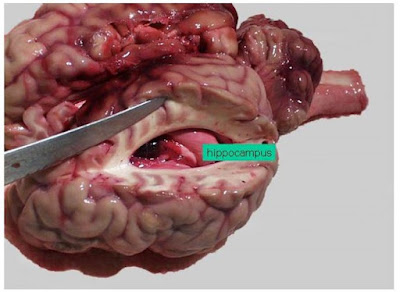 |
| Ammon horn, dalam incisi permukaan dorsal otak |
Pembukaan lalu diperluas dengan menginsisi hemisphere otak, dan tanduk Ammon’s (ammon’s horn) akan tampak dalam bentuk semi-silinder, putih, lebih mengkilap dari bagian ventikel, dan konturnya spiral.
Persiapan preparat
Preparat sebaiknya dibuat dari tanduk ammon’s (ammon’s horn) pertama bagian kortek dan akhirnya dari bagian cerebellum. Jaringan sampel (sekurang-kurangnya enam) sebaiknya diambil masing-masing 3 dari area tadi tiap preparatnya dan diperiksa secara mikroskopis sebelum akhirnya otak dilaporkan negatif atau positif rabies.
Dan lebih baik lagi untuk memilih bagian dari hippocampus untuk mendapatkan hasil yang lebih baik.
Sebagai catatan, jaringan otak yang dipakai sebaiknya dalam keadaan masih segar untuk hasil yang lebih baik.
Metode impressi
Dengan sepasang gunting, potong kecil bagian jaringan otak (tanduk ammon’s, cerebrum, atau cerebellum) secara transversal (setebal 2-3 mm) dan tempatkan jaringan tersebut pada kertang pengering atau tissue yang bersih atau dengan kayu pegangan es krim, potong bagian yang menghadap ke atas.
Ambil Kaca preparat kemudian sentuhkan pada bagian permukaan yang terpotong ytadi dan tekan pelan-pelan dengan tekanan secukupnya untuk membuat penyebaran setipisnya dari jaringan otak. Sesuai dengan ukuran tadi, 3-4 impressi dapat dibuat pada satu kaca preparat.
 |
| Metode impressi |
Ketika masih basah, kaca preparat dicelupkan kedalam pewarnaan seller beberapa detik (1-5 detik), cuci dengan air mengalir, dan keringkan dalam suhu ruangan. Preparat siap untuk diperiksa.
Metode impresi ini dapat diperika secara langsung dengan oil emersi atau dengan cove glass yang dimounting dengan etellan. Metode ini lebih disukai dari metode lain karena jaringan saraf dapat diperiksa semaksimal mungkin dengan kerusakan seluler yang minimal.
Metode Smear
Metode smear ini dilakukan dengan menempatkan potongan otak sekecil mungkin di bagian ujung kaca preparat. Lalu ujung kaca preparat yang lain ditempatkan secara vetikal di atas jaringan otak dengan sudut 450, lalu digesekan satu arah sepanjang kaca preparat pertama.
Hasilnya adalah lapisan tipis jaringan otak yang homogeny yang dapat dibagi menjadi tiga bagian. Pada teknik ini jaringan akan tersebar pada bagian akhir daripada bagian yang pertama (tebal). Metode ini harus dilakukan hati-hati agar tidak menghasilkan lapisaan jaringan yang tebal, yang membuat pewarnaan dan pemeriksaan mikroskopis sulit dilakukan.
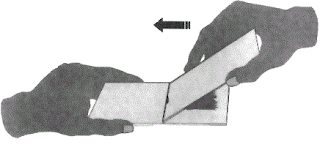 |
| metode smear (ulas) |
Metode Rolling
Metode terakhir adalah teknik rolling, dilakukan dengan memotong bagian jaringan otak dengan diameter 5 mm, dan digulung di atas kaca preparat perlahan-lahan dengan tusuk gigi.
Pewarnaan seller direkomendasikan disini karena keakuratan dan kesederhaannnya. Pada teknik ini, tidak ada fiksasi, dan lapisan jaringan dapat dihasilkan dan diwarnai secara serentak, membuat teknik ini menjadi teknik yang paling cepat dan mudah ditangani.
Negri body : diagnosis differensial
Meskipun secara umum bentuknya bulat, negri body dapat ditemukan dalam berbagai bentuk. Dalam waktu bervariasi di laboratorium yang berbeda telah ditemukan negri body berbentuk bulat, oval, spheroid, amuboid, triangular, dan sebagainya.
Dari segi ukuranpun bentuknya juga memiliki banyak variasi, umumnya ditemukan berukuran 0,24 sampai 27,0 µm. Ditandai dengan sifat asidofilik dalam reaksi pewarnaan, dan mengambil warna pink hingga merah magenta (merah keunguan) pada pewarnaan diferensial yang menggunakan basic fuchsin atau eosin dengan methylen blue sebagai dasar.
Negri body ditemukan di dalam sitoplasma sel neuron, khususnya diantara nukleus dan sudut dari sel neuron, atau bagian memanjang dari badan sel. Karakteristik utana negri body adalah struktur internalnya.
Matrik negri body bersifat asidofilik dalam reaksi pewarnaan, dan berisi struktur merah magenta pada bagian kecil dalam badanya, basofilik granul bewarna biru gelap hingga hitam.
Ukuran granul tersebut umunya bervariasi mulai dari 0,2-0,5 µm. Granul yang lebih besar teletak di tengah sel, dan granul yang lebih kecil berkumpul disekitar tepi sel Negri body. Namun sayangnya granul-granul ini sangat sulit untuk dilihat.
Dalam kesepakatan universal, bahwa negri body digunakan sebagai diagnosis spesifik rabies, dan kehadirannya selalau mengindikasikan adanya infeksi pada hewan terkena. Selain itu, bentuk utuh dari negri body tidak bisa dikelirukan dengan bentukan inklusi body yang lain.
Namun, beberapa tipe badan inklusi lain terkadang dapat ditemukan pada otak hewan yang sedang didiagnosis, dan karena kesamaannya, akhirnya dapat dikelirukan dengan Negri body.
Contohnya, sifat asidofilik inklusi body dari canine distemper atau Rubarth disease (canine infectious hepatitis, fox encephalitis) terkadang menyerang otak anjing dan rubah liar. Bentukan inklusi ini sering ditemukan pada bagian thalamus, dan lentiform nukleus daripada hipocampus.
Dalam kasus yang sama, otak kucing yang tidak terkena rabies dan mencit laboratoris terkadang mengandung badan inklusi asidofilik yang non-spesifik ketika sedang menjalankan diagnosis rabies.
Semua bentuk inklusi body non-spesifik ini juga dapat tewarnai dalam pewarnaan Seller, namun badan inklusi non-spesifik ini, dapat dibedakan dengan Negri body dalam pewarnaan Seller. Berikut karakteristik yang dapat digunakan sebagai pembanding:
Badan inklusi intrasitoplasmik atipikal terkadang ditemukan pada hewan yang dibunuh dalam tahap awal rabies. Untuk hal ini, disarankan untuk menahan anjing yang dicurigai rabies untuk dikarantinakan, daripada dibunuh secepatnya, dan otaknya dikirim ke laboratorium untuk didiagnosis.
Badan inklusi intrasitoplasmik atipikal terkadang ditemukan pada hewan yang dibunuh dalam tahap awal rabies. Untuk hal ini, disarankan untuk menahan anjing yang dicurigai rabies untuk dikarantinakan, daripada dibunuh secepatnya, dan otaknya dikirim ke laboratorium untuk didiagnosis.
Ada dua hal penting di sini. Pertama, memungkinkan dapat dilakukan observasi untuk simptom-simptom yang berkaitan dengan rabies, yang dapat digunakan untuk membuat diagnosis klinis penyakit.
Kedua, semakin lama hewan tersebut hidup, semakin besar kesempatan untuk mendapatkan hasil positif dalam diagnosis mikroskopis. Lama waktu sakit secara klinis secara langsung berhubungan dengan ukuran, dan pembentukan, Negri bodies.
Tes inokulasi pada mencit
Sejak negri body tidak selalu dapat ditemukan pada otak hewan rabies yang mati. Maka penting untuk spesimen yang diduga negatif untuk dites ulang dengan inokulasi pada hewan. Suatu survei telah dilakukan dalam kasus rabies yang besar, menunjukan 10-15% kasus yang dipastikan positif dengan inokulasi pada tikus ternyata meleset dengan pemeriksaan mikroskopis dengan metode smear.
Sehingga ini sangat direkomendasikan bahwa laboratorium sebaiknya dilengkapi dengan peralatan yang mumpuni untuk pelayanan diagnosis untuk menindaklanjuti tes inukulasi pada hewan pada jaringan otak hewan yang diduga negatif rabies, contohnya seperti Flourscent antibody test (FAT).
 |
| inokulasi mencit umur 2-3 minggu |
Di masa lalu, marmut dan kelinci dipilih sebagai hewan uji yang paling cocok untuk tujuan diagnosis. Namun, sejak injeksi intraserebral telah diperkenalkan pada mencit atau tikus putih yang menghasilkan infeksi konstan spesifik, maka mencit sekarang dipilih sebagai hewan uji yang utama.
Hal ini dikarenakan, mencit membutuhkan biaya yang rendah, memungkinkan untuk menggunakan beberapa hewan dalam satu spesimen, masa inkubasi yang relatif pendek, dan konsisten menghasilkan negri body pada hewan yang telah diinokulasi dengan injeksi intraserebral. Mencit yang masih menyusui (kurang dari 3 hari) lebih mudah atau rentan menerima rabies daripada mencit yang lebih tua.
Agen antimikrobial untuk kontaminasi dan dekomposisi spesimen
Sering sulit sekali untuk mendapatkan hewan di lapangan yang otaknya masih dalam keadaan steril bakteriologis.
Kepala hewan mungkin sudah dikirim dalam waktu yang alama, atau hewan diambil setelah jangka kematian yang cukup lama, ditembak, atau dipukul kepalanya denganbenda tumpul. Dan Juga, kematian dapat disebabkan oleh encephalitis bacterial.
Injeksi intraserebral bakteri menyebabkan kematian mencit yang telah diinokulasi dalam waktu 1-3 hari atau lebih, sebelum virus rabies muncul pada inokulum yang memiliki jangka periode inkubasi yang cukup.
Di kondisi yang lain, mencit dapat hidup lebih lama hingga masa periode inkubasi rabiesnya tercapai sempurna, dan menunjukan symptom spesifik rabies sperti tremor, paralysis, dan prostrasi, diikuti kematian, dan menunjukan negri bodies spesifik dan banyak bakteri pada pemeriksaan otak.
Ketika suatu sampel dicurigai mengalami kontaminasi bakteri seperti otak hewan telah mengalami dekomposisi, penanganan terbaik adalah memberikan agen antimikroba pada suspensi otak sebelum meningokulasikannya pada mencit.
- Penicilin dan streptomysin akan memberikan hasil yang terbaik. Jika kedua gen ini tidak ada, bisa menggunakan agen antimikroba yang lain.Penicillin dan streptomysin. Tambahkan 500 IU sodium benzylpenicillin dan 2 mg (1560 IU) streptomysin per ml suspensi jaringan. Biarkan dulu selama 30 menit pada suhu ruang sebelum diinjeksikan. Dosis ini biasanya cukup, namun untuk kontaminasi berat gunakan sebanyak 1000 IU penicillin dan 3 mg (2340 IU) streptomisin.
- Gliserol. Simpan specimen otak dalam gliserol murni selama 48 jam
- Phenol 0,5 %. Buatlah 0,5 % phenol dalam larutan garam fisiologis. Agen ini digunakan sebagai diluents untuk membuat 10 % jaringan inokulum. Simpan selama 6 jam atau sepanjang malam. Jika sudah disimpan selama 6 jam dalam temperature ruangan. Jika lebih dari 6 jam simpan suspensi sepanjang malam dalam refrigerator.
- Thiomersal 1 : 5000. 1 : 5000 thiomersal dalam larutan garam fisiologis. Agen ini digunakan sebagai diluents untuk membuat 10 % jaringan inokulum. Simpan selama 6 jam atau sepanjang malam. Jika sudah disimpan selama 6 jam dalam temperature ruangan. Jika lebih dari 6 jam simpan suspensi sepanjang malam dalam refrigerator
Untuk menentukan ada tidaknya kontaminasi bakteri, sebagian jaringan emulsi sebaiknya dikultur pada dextrose infusion broth atau media serupa, dan di goreskan pada media blood agar. Jumlah yang direkomendasikan sekitar 0,1 ml emulsi dalam 3 ml media encer (broth). Media sebaiknya diinkubasi dalam satu malam pada suhu 37,5 derajat C.
Persiapan Perwarnaan Seller’s
Dalam Perwarnaan seller’s, Negri’s body dibedakan dengan warna merah magenta (heliotrop) hingga merah cerah, dengan bagian dalam bewarna biru gelap atau basofilik gelap. Seluruh bagian sel syaraf akan bewarna biru dan jaringan intertisial bewarna pink. Eritrosit akan bewarna merah copper dan dapat dengan mudah dibedakan merah magenta-merah cerah dari negri body.
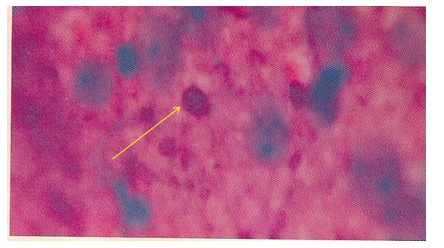 |
| Negri bodies dalam pewarnaan Seller's. Berwarna Merah Magenta dan ada Granula Berwarna Biru |
 |
| Negri bodies dalam pewarnaan seller's. (sumber : http://www.gettyimages.com/detail/photo/sellers-stain-light-micrograph-of-negri-high-res-stock-photography/128616019) |
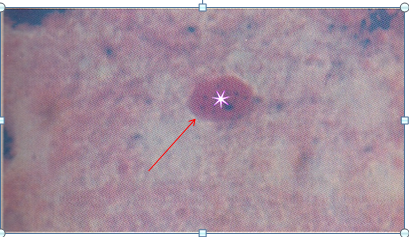 |
| Negri bodies dalam pewarnaan Seller's. warna merah oblong |
Bahan membuat pewarnaan :
1. Methylen blue......................................................................................... 10 gr
Methanol (absolute aceton free).................................................................1000 ml
Dua bahan diatas dicampur dalam satu wadah
2. Basic fuchsin............................................................................................ 5 gr
Methanol (absolute aceton free)..................................................................500 ml
Dua bahan diatas dicampur dalam satu wadah
Larutan yang sudah dicampur tadi disimpan didalam botol yang dapat mencegah penguapan larutan (seperti botol dengan tutup yang diputar). Larutan juga sebaiknya mengandung tidak kurang dari 85% methylen blue, dan tidak kurang dari 92% basic fuchsin.
Larutan yang sudah dicampur tadi disimpan didalam botol yang dapat mencegah penguapan larutan (seperti botol dengan tutup yang diputar). Larutan juga sebaiknya mengandung tidak kurang dari 85% methylen blue, dan tidak kurang dari 92% basic fuchsin.
Jika methanol absolut aceton free tidak ada, bisa menggunakan Methanol murni (chemical pure).
Larutan pewarna
Methylen blue (larutan nomor 1).....................................................................2 bagian
Basic fuchsin (larutan nomor 2)......................................................................1 bagian
Larutan pewarna
Methylen blue (larutan nomor 1).....................................................................2 bagian
Basic fuchsin (larutan nomor 2)......................................................................1 bagian
Campurkan seluruhnya larutan diatas, tapi jangan disaring. Simpan dalam wadah yang dapat mencegah terjadinya penguapan. Larutan pewarna sebaiknya didiamkan terlebih dahulu selama 24 jam sebelum digunakan dan setelah itu dapat disimpan tanpa batas waktu, selama larutan tersebut tidak mengalami evaporasi.
Pengaturan pewarna
Ketika larutan pewarna telah dipersiapkan dengan baik dan akurat, proporsi di atas akan menghasilkan warna yang diharapkan sebagai pembeda.
Namun, disarankan untuk membuat warna percobaan, dan jika hasil yang didapatkan tidak sesuai dengan warna normal, maka warna siap untuk diatur kembali.
Jika bagian stroma bewarna merah cerah daripada merah mawar atau pink pada area yang lebih tipis, dan seluruh efek warna cenderung kemerahan, artinya fuchsin terlalu dominan.
Tambahkan cadangan larutan methylen blue di atas dalam jumlah yang sudah ditentukan/ditakar, cek kembali dengan pewarna percobaan tiap penambahan larutan hingga balance warna sesuai dengan yang diharapkan.
Ketika methylen blue terlalu dominan, Negri body akan berwarna merah maroon gelap dan sel syaraf cenderung lebih gelap. Dalam hal ini, tambahkan fuchsin secukupnya.
Prosedur pewarnaan
- Preparat disentuhkan ke sampel otak, lalu tipiskan lagi dengan menyentuhkan hasil sentuhan tadi ke tissue. Di sini fiksasi tidak perlu dilakukan.
- Ketika preparat masih dalam keadaan lembab, sesegera mungkin celupkan preparat tadi ke larutan pewarna selama 1-5 detik, tergantung pada ketebalan dari hasil sentuhan otak.
- Bilas dengan air mengalir, dan keringkan.
Dibeberapa wilayah air keran tidak memberikan hasil yang memuaskan untuk pembilasan. Kecocokan air ini dapat ditentukan dengan membandingkan pembilasan preparat dengan air keran dengan pembilasan lain menggunakan air detilasi yang mengandung 0,66 mol/l phosphat buffer, pH 7.0.
Ketika tidak digunakan, larutan pewarna harus disimpan didalam kontainer yang tertutup rapat untuk mencegah evaporasi, yang dapat mengakibatkan fuchsin menjadi terlalu dominan.
Ketika tidak digunakan, larutan pewarna harus disimpan didalam kontainer yang tertutup rapat untuk mencegah evaporasi, yang dapat mengakibatkan fuchsin menjadi terlalu dominan.
Hasil terbaik didapatkan ketika jaringan otak masih segar. Dan jika jaringan otak telah mengalami dekomposisi, hal ini akan mempengaruhi karakteristik diferensiasi warna, meskipun kualitas warna negri body tetap bertahan, seluruh jaringan preparat sentuh akan menjadi lebih merah atau terlalu biru, sehingga identifikasi negri body akan jauh lebih sulit.
Daftar pustaka
Meslin FX, Kaplan MM, Koprowski H. 1996. Laboratory techniques in rabies. World Health Organozation. Genewa
Pemeriksaan mikroskopik cepat untuk Negri bodies dan persiapan spesimen untuk tes biologis
 Reviewed by kangmaruf
on
2:48 PM
Rating:
Reviewed by kangmaruf
on
2:48 PM
Rating:
 Reviewed by kangmaruf
on
2:48 PM
Rating:
Reviewed by kangmaruf
on
2:48 PM
Rating:









No comments: